-
Produkte
-
Laborgeräte
-
Labor-Messgeräte und Elektroden
Kalibrierstandards
- Chemikalien, Reagenzien und Standards
-
Online-Analysatoren
-
Online-Sensoren und Controller
Digitale Controller (Transmitter) Controller (analog)
- SC4500
- Orbisphere 366x Ex
- Orbisphere 410/510 Kohlendioxid
- Orbisphere 410/510 Ozon
- Orbisphere 410/510 Sauerstoff
- Orbisphere 51x Wasserstoff
- 3400 Analoge Kontakt-LF
- 3400 Digitale Kontakt-LF
- 3700 Analoge induktive LF
- 3700 Digitale induktive LF
- 3798 sc Elektrodenfrei
- 9523 Kationische Leitfähigkeit
- 9525 DCCP System
pH- und Redox-Sonden- 12 mm pH/Redox
- 1200-S Redox
- 1200-S pH
- 8362 sc Reinstwasser
- Differential pH
- Digital Differential Redox
- Digital Differential pH
- Kombination pH/Redox
- LCP Redox
- LCP pH
Sonden für gelösten Sauerstoff- 5500 Clark O2 (gelöst)
- LDO 2 sc
- Orbisphere 311xx
- Orbisphere GA2x00
- Orbisphere K1X00
- Orbisphere M1100
- Orbisphere Sauerstoff ppb
- Automatisierte Laborsysteme
- Multiparameter Online Panels
- Claros Water Intelligence System
- Probenehmer
-
Laborgeräte und Verbrauchsmaterial
Instrumente Allgemeines LaborverbrauchsmaterialGeräteGlas-/KunststoffprodukteLiteratur und Referenzmaterial
- Testkits und Streifen
-
Mikrobiologie
Gebrauchsfertige Nährmedien
- BART Tests
- Flüssiges MPN
- Gesamtkeimzahl Nährmedien
- Hefe und Schimmelpilze
- MUG Röhrchen
- Membran-Filtration
- P/A (An-/Abwesenheit)
Laborbedarf- Flaschen, Röhrchen, Küvetten und Gestelle
- Mikrobiologie Filter
- Petrischalen & Zubehör
- Probensammelbeutel
- Trichter, Pumpen und Anschlüsse
- Zubehör
Trockennährmedien Zubehör und Chemikalien
-
Laborgeräte
- PARAMETER
-
Softwarelösungen
-
Claros Water Intelligence System
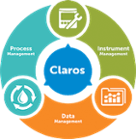
Produktsäulen Process Management
- Lösungen für:
- BSB-/CSB-Entfernung
- Nitrifikation/Denitrifikation
- Phosphorelimination
- Schlammbehandlung
Data Management- Lösungen für:
- Erfassung
- Visualisierung & Analyse
- Berichterstattung
- Datengenauigkeit
Instrument Management- Lösungen für:
- Wartung
- Fehlerbehebung
- Fernzugriff
- Labor- und Prozessvergleich
Branchenheraus-
forderungen Einhaltung gesetzlicher Vorschriften Kosteneinsparungen Fernbetrieb Data Management Prozessoptimierung Gerätewartung
-
Claros Water Intelligence System
- Branchen
- Service
- News & Events
Austria
Wählen Sie Ihr Land oder Ihre Region aus:
Europe
Americas
Asia - Australasia
- Australia
- Mainland China
- India
- Indonesia
- Japan
- Malaysia
- New Zealand
- Philippines
- Singapore
- South Korea
- Thailand (Thai)
- Taiwan
Middle East - Africa
Ammoniak und Ammonium
Was ist Ammoniak?
Ammoniak ist eine farblose, stechend riechende, gasförmige Verbindung aus Wasserstoff und Stickstoff (ein Stickstoffatom und drei Wasserstoffatome, NH3), die in Wasser hoch löslich ist.
Ammoniak wird auf natürliche Weise als Produkt aus der mikrobiologischen Zersetzung von stickstoffhaltigem organischem Material (tierisches und pflanzliches Protein) gebildet. Es wird auch für den Einsatz in Düngemitteln oder zur Produktion von Kunststoffen, Pharmazeutika und anderen Chemikalien hergestellt.
Ammoniak im Grundwasser ist aufgrund mikrobiologischer Prozesse normal. Das Vorliegen von Ammoniakstickstoff im Oberflächenwasser weist jedoch in der Regel auf eine lokale Verschmutzung hin. Übermäßige Mengen an Ammoniak können die Vegetation schädigen und sind, insbesondere bei erhöhtem pH-Wert und hohen Temperaturen, äußerst giftig für Wasserorganismen.
Ammoniaklösung
Bei verschiedenen Anwendungen wird Ammoniak in Wasser gelöst, um „Ammoniakwasser“ zu erzeugen. Wässrige Ammoniaklösungen (Ammoniakwasser) sind instabil, und die Ammoniakkonzentration kann während des Transports oder der Lagerung abnehmen.
Was ist Ammonium?
Ammonium ist eine Verbindung, die ein Stickstoff- und vier Wasserstoffatome enthält (NH 4 +). Während Ammoniak ein neutrales, nicht ionisiertes Molekül (schwache Base) ist, ist Ammonium ein Ion mit positiver Ladung. Darüber hinaus erzeugt Ammoniak einen starken Geruch, aber Ammonium riecht überhaupt nicht.
Der Hauptfaktor, der den Anteil von Ammoniak gegenüber Ammonium in Wasser bestimmt, ist der pH-Wert. Die Aktivität des Ammoniaks wird auch von der Ionenstärke und Temperatur der Lösung beeinflusst. Es darf nicht vergessen werden, dass molekulares Ammoniak zwar für Wasserorganismen schädlich sein kann, Ammonium-Ionen jedoch grundsätzlich harmlos sind. In der Wasserindustrie ist es wichtig, die Konzentration von wasserstoffgebundenem Stickstoff zu kennen. Daher werden die Begriffe Ammoniak und Ammonium (mitunter) synonym verwendet, entsprechend als NH 3 -N oder NH 4 -N dargestellt und normalerweise in mg/L oder ppm Stickstoff (N) angegeben.
Die chemische Gleichung, die das Verhältnis zwischen Ammoniak und Ammonium bestimmt, lautet:;
NH 3 + H 2O <-> NH 4 + + OH -
Wenn der pH-Wert niedrig ist, verlagert sich das Gleichgewicht nach rechts. Ist der pH-Wert hoch, verlagert sich das Gleichgewicht nach links. Im Allgemeinen ist der Anteil von Ammoniak‐N als NH 3 bei Raumtemperatur mit einem pH-Wert von weniger als 6 sehr gering, und fast der gesamte Ammoniakstickstoff ist als NH 4 + vorhanden. Bei einem pH-Wert von etwa 8 beträgt der NH 3-Anteil 10 Prozent oder weniger, und bei einem pH-Wert von etwas über 9 liegt er bei etwa 50 Prozent. Sobald der pH-Wert höher als 11 ist, werden alle Ammonium-Ionen in der Lösung in die molekulare Form von Ammoniak umgewandelt. Die Aktivität von wässrigem Ammoniak ist bei niedrigen Temperaturen viel geringer.
Warum Ammoniaküberwachung?
Ammoniak wird sowohl als Reagenz als auch als Messparameter in mehreren Bereichen der Wasser- und Abwasseraufbereitung verwendet.
- Das natürlich vorkommende Ammoniak wird im Quellwasser überwacht.
- Während des Desinfektionsprozesses der Chloraminierung wird Ammoniak mit Chlor kombiniert, um Trinkwasser zu behandeln und in Verteilersystemen länger anhaltende Aktivitäten zu erreichen.
- Manchmal wird Ammoniak zur pH-Einstellung verwendet, z.B. in der Pharmaindustrie.
- Ammoniak wird weithin bei der Nitrifikation und Denitrifikation in Abwasser überwacht.
Zwar ist Ammoniak bei niedrigen Konzentrationen im Allgemeinen harmlos, doch hohe Ammoniakkonzentrationen können zu Schäden führen und Gesundheitsrisiken darstellen. Daher müssen die Ammoniakwerte ordnungsgemäß überwacht und eingehalten werden.
Bei Hach® finden Sie die Messgeräte, Verfahren, Schulungen und Software, die Sie benötigen, um den Ammoniakgehalt in Ihrer spezifischen Prozessanwendung erfolgreich zu überwachen und zu steuern.
Empfohlene Produkte zur Ammoniaküberwachung
Hach bietet viele der führenden Spektralphotometer auf dem Markt der Wasseranalytik.
Jetzt kaufenDie benutzerfreundlichen, robusten und tragbaren Messgeräte von Hach sind für die besonderen Belastungen vor Ort ausgelegt.
Jetzt kaufenHQ440D Labor-Messgerät Ammoniak (NH₃) mit ionensensiver Elektrode ISENH3181
Das Hach HQ440D Labor-Multimeter ist ein innovatives Labormessgerät, mit dem Sie zuverlässige Messergebnisse erhalten.
Jetzt kaufenHQ440D Labormessgerät Ammonium (NH₄⁺) mit ionensensitiver Elektrode ISENH4181
HQD Messgeräte werden mit intelligenten Intellical Elektroden verbunden und die Messparameter werden automatisch erkannt.
Jetzt kaufenDie HQ-Serie ist für Fachleute im Bereich Wasserqualitätssicherung gedacht, die elektrochemische Analysen in Feld- und Laborumgebungen durchführen möchten.
Jetzt kaufenDer Amtax sc Online-Analysator von Hach mit Gas-sensitiver Elektrode wird zur hochpräzisen Bestimmung der Ammoniumkonzentration direkt im Aufbereitungsprozess (Installationen im Außenbereich) eingesetzt.
Jetzt kaufenDie Online-Analysatoren der EZ Serie bieten mehrere Möglichkeiten zur Überwachung von Ammonium in Wasser.
Jetzt kaufenDie digitale, ionenselektive A-ISE sc Sonde von Hach dient zur Bestimmung der Ammoniumkonzentration direkt im Medium.
Jetzt kaufenDer digitale AN-ISE sc Sensor von Hach für Ammonium und Nitrat führt über eine ionenselektive Elektrode kontinuierliche direkte Messungen durch.
Jetzt kaufenSL1000 Portabler Parallel-Analysator (PPA)
Der SL1000 portable Parallel-Analysator (PPA) von Hach führt Messungen mit weniger als der Hälfte der sonstigen manuellen Arbeitsschritte durch.
Jetzt kaufenAmmonium Reagenzien für SL1000
Hach hat es sich zum Ziel gesetzt, hochwertige Reagenzien für routinemäßige und anspruchsvolle Wasseranalysen bereitzustellen.
Jetzt kaufen
Für welche Prozesse ist die Ammoniaküberwachung erforderlich?
Trinkwasseraufbereitung
Gasförmiges Ammoniak und konzentrierte Lösungen davon müssen vorsichtig und gemäß den entsprechenden Vorschriften gehandhabt werden. Der Grund dafür sind stark korrodierende Eigenschaften, die je nach Konzentration schwerwiegende Gesundheitsrisiken bergen können, von leichten Augen- oder Hautreizungen bis hin zu Verätzungen. Darüber hinaus kann austretendes Ammoniak Probleme wie unangenehmen Geschmack oder Geruch verursachen.
Wenn Ammoniak nicht zur Desinfektion verwendet wird, kann sein Vorkommen in einem Verteilersystem auf Auslaugung von in der Rohrleitungskonstruktion verwendeten Materialien oder auf eine Wasserkontamination aufgrund von Schäden im System hinweisen. Wenn sich unerwünschtes Ammoniak mit Chlor verbindet, verringert dies die Desinfektionsstärke der Chlorung.
Chloraminierung
Bei einigen Desinfektionsprozessen wird Ammoniak mit Chlor kombiniert, um Monochloramin zu erzeugen. Obwohl freies Chor ein stärkeres Desinfektionsmittel ist, hat Monochloramin (gebundenes Ammoniak und Chlor) eine höhere Stabilität, sodass es länger im Verteilersystem verbleibt und die Desinfektion bis zum Endverbraucher aufrechterhalten wird. Außerdem reagieren Chloramine weniger intensiv mit verschiedenen Verunreinigungen im Rohwasser, insbesondere mit organischen Substanzen, und minimieren so die Bildung von einigen karzinogenen Desinfektionsnebenprodukten (DNP). Um den Chloraminierungsprozess zu optimieren, ist es wichtig, die Bildung der Zielspezies für die Desinfektion zu überwachen und gleichzeitig die Bildung von weniger wünschenswertem Dichloramin oder Trichloramin zu verhindern. Monochloramin-Tests werden zusammen mit einer Bestimmung des freien Ammoniaks verwendet, um die Bildung des richtigen Desinfektionsmittels sicherzustellen und die Rohmaterialkosten zu senken, indem eine Überdosierung von Chlor und/oder Ammoniak verhindert wird.
Erfahren Sie mehr über die Chloraminierung.
Freies Ammoniak
Ammoniak, das während der Chloraminierungs-Desinfektion nicht an Chlor gebunden ist, wird als freies Ammonium/Ammoniak (NH 4 + und NH 3) bezeichnet. Bei einem neutralen pH-Wert und Umgebungstemperatur besteht fast das gesamte freie Ammoniak aus NH 4 +. Mit zunehmendem pH-Wert und zunehmender Temperatur steigt der Anteil von NH 3, und der Anteil von NH4+ sinkt. Wenn chloraminiertes Wasser freigesetzt wird, steigt der Gehalt an freiem Ammoniak, da Monochloramin mit verschiedenen organischen Stoffen und Bakterien im Wasser des Verteilersystems reagiert. Erhöhte Werte von freiem Ammoniak weisen auf den Beginn der Nitrifikation hin. Ein plötzlicher Abfall des freien Ammoniaks deutet darauf hin, dass die Nitrifikation in Gange ist und Nitrit gebildet wird. Der Wert des freien Ammoniaks ist hilfreich, um die Menge an freiem Chlor zu bestimmen, die zur Erhöhung der Monochloramin-Rückstände erforderlich ist. Der Gehalt an freiem Ammoniak kann durch Hinzufügen von freiem Chlor im Verhältnis von 5:1 als Cl 2 : N reduziert werden, um den Prozess entsprechend zu führen und das Nitrifikationspotenzial zu minimieren.
Gesamt-Ammoniak/Ammonium
Gesamt-Ammoniak/Ammonium ist die Summe des gesamten Ammoniakstickstoffs in Form von Monochloramin (NH 2Cl), anderen Chloraminen, Ammonium-Ionen (NH 4 +) und molekularem Ammoniak (NH 3). Dieser Parameter kann als primäre oder sekundäre Überprüfung dienen, um den Chloraminierungsprozess unter Kontrolle zu halten.


Aufbereitung von Oberflächen- und Grundwasser
Ammoniak wird als Nebenprodukt gebildet, wenn Bakterien natürliche Materialien im Boden aufschließen. Hohe Ammoniakkonzentrationen können durch eisenreiche Böden, die Nähe zu Wäldern oder durch Kontamination mit Düngemitteln oder Fäkalien hervorgerufen werden.

Abwasseraufbereitung
Bei der Abwasseraufbereitung kann der Ammoniumgehalt aufgrund der bakteriellen Aktivität extrem hohe Konzentrationen erreichen. Ammonium wird zunächst durch den Nitrifikationsprozess in Nitrat umgewandelt, sodass es durch Denitrifikation zu atmosphärischem Stickstoff (N2) reduziert werden kann. Erfahren Sie mehr über die kommunale Abwasseraufbereitung. Bei hohen Konzentrationen und pH-Werten kann Ammonium für Mikroorganismen bei der Schlammfaulung giftig sein. Um Schäden an Wasserorganismen zu verhindern, ist es außerdem entscheidend, Ammonium zu überwachen und aus dem Abwasser zu entfernen, bevor es in natürliche Gewässer freigesetzt wird.

Aquakultur
Als Abfallprodukt von Wasserorganismen kann Ammonium bei einer Konzentration von nur 0,5 mg/L giftig für Fische und Wasserpflanzen sein. In etablierten Aquarien kann Ammonium schnell in Nitrit und schließlich Nitrat umgewandelt werden. Bei den meisten Aquarien besteht das Ziel darin, Ammoniumgehalte zu vermeisen.
In natürlichen Gewässern können hohe Ammoniumwerte zu übermäßigem Algenwachstum führen, das das Sonnenlicht blockiert und die Sichtfütterung sowie die Fotosynthese beeinträchtigen kann.

Landwirtschaft
Da Pflanzen Stickstoff nicht direkt aus der Atmosphäre nutzen können, setzen sie auf stickstofffixierende Bakterien, um Stickstoff in Ammonium umzuwandeln. Stickstoff in Form von Ammonium kann dann von Pflanzen verwendet werden, um andere essenzielle organische Moleküle zu bilden, die von komplexen Organismen benötigt werden. Um diesen natürlichen Prozess (der Teil des Stickstoffzyklus ist) zu unterstützen oder zu verbessern, wird dem Dünger häufig Ammonium zugegeben. So wird beispielsweise Stickstoff als Ammoniumsalz in hydroponische Nährstofflösungen eingebracht. Auch aufgrund der Düngung mit Harnstoff und der nachfolgenden Zersetzung, kann Ammonium im Boden vorhanden sein.

Pharmazeutische Produktion
In der pharmazeutischen Industrie wird Ammoniak zur pH-Kontrolle verwendet, und Ammoniaklösungen werden zur Regeneration schwacher Ionenaustauschharze und zur pH-Einstellung verwendet.
Wie wird Ammoniak/Ammonium überwacht?
Salicylat-Methode
Die Salicylat-Methode ist eine Variante der bekannten Indophenolblau-Methode, hat jedoch den Vorteil, dass sie frei von Quecksilbersalzen und Phenol ist. Diese Methode eignet sich besonders für die Bestimmung von Ammoniumstickstoff im niedrigen Messbereich. Obwohl das Verfahren mehrere Schritte umfasst, bevor eine endgültige grüne Farbe entwickelt wird, sind alle Reagenzien in praktischen Pulverkissen (Pulverkissen mit Salicylat-Reagenz und Pulverkissen mit alkalischem Cyanurat) oder in LCK-Küvettentests enthalten,
- Ammoniumverbindungen reagieren mit Hypochlorit und bilden Monochloramin.
- Das Monochloramin reagiert dann mit Salicylat und bildet 5-Aminosalicylat.
- Die Oxidation von 5-Aminosalicylat wird in Gegenwart eines Katalysators, Nitroprussid (auch Nitroferricyanid genannt), durchgeführt. Dies führt zur Bildung von Indosalicylat, einer blau gefärbten Verbindung. Die blaue Farbe wird durch die gelbe Farbe (von überschüssigem Nitroprussid) überlagert, was zu einer grünen Färbung führt. Die Farbintensität des Grüns ist direkt proportional zur Ammoniumkonzentration in der Probe.
Abwasser oder
|
Chloraminierung |
|
Tischgerät: Tragbar: DR300 Pocket Colorimeter Ammonium Online: |
Tragbar: Chemkeys für freies Ammoniak und Monochloramin DR300 Pocket Colorimeter Monochloramin/freies Ammonium Tischgerät: |

Gassensitive Elektrode
Die Ammoniak-Elektrode misst Ammoniakgas in wässrigen Lösungen sowie Ammonium-Ionen, die durch Hinzufügen einer starken Base in Ammoniak-Gas umgewandelt wurden. Die Elektrode ist eine vollständige elektrochemische Zelle, die aus einer pH-Glaselektrode und einer Referenzelektrode besteht. Die gasdurchlässige Membran trennt die Probe von einer dünnen Elektrolytschicht, die zwischen die pH-Kugel und die Membran gepresst wird. Bei hohem pH-Wert werden Ammonium-Ionen in Ammoniak-Gas umgewandelt. Das Gas diffundiert durch die Membran und verursacht eine pH-Änderung in der dünnen Elektrolytschicht. Das Potenzial des pH-Glases ändert sich infolge der pH-Änderung, und die Elektrode misst die Potenzialänderung. Die gemessene pH-Änderung ist proportional zur Ammoniakkonzentration in der Lösung.
Tischgerät:
Intellical ISENH3181 ionenselektive Elektrode (ISE) für Ammoniak
Online:
Nessler-Methode
Beim Ammonium-Test reagiert das Nessler-Reagenz (K2HgI4) mit dem in der Probe vorhandenen Ammonium (unter stark alkalischen Bedingungen) unter Bildung eines gelben Farbkomplexes. Die Farbintensität ist direkt proportional zur Ammoniumkonzentration.
2K 2HgI 4 + NH 3 + 3KOH → Hg 2OINH 2 + 7KI + 2H 2O
Tischgerät:
Tragbar:
Online:
Häufig gestellte Fragen
Welche Methoden können verwendet werden, um Ammonium im Abwasser an die EPA zu melden?
Ammoniumstickstoff kann mit einem Spektralphotometer (oder Colorimeter) oder einer ionenselektiven Elektrode (ISE) für Ammoniak/Ammonium gemessen werden. Im Folgenden werden anerkannte oder gleichwertige Methoden der United States Environmental Protection Agency (USEPA) für die Abwasseranalyse aufgeführt.
Stickstoff-Ammonium-Nessler-Methode 8038 – USEPA-zugelassen für Abwasseranalyse (Destillation erforderlich), Methode 350.2.
Nitrogen-Ammonia TNTplus Method 10205 - Equivalent
Nitrogen Ammonia Ion Selective Electrode (ISE) method 10001 and 10002 - These procedures can be used for standard methods for the examination of water and wastewater 4500-NH3 E for USEPA NPDES reporting.
Warum sind LCK Ammoniak-Salicylat-Reagenzien EPA-gleichwertig, die LCK Salicylat-Reagenzien jedoch nicht?
Die LCK Ammonium-Reagenziensätze LCK304, LCK303 und LCK305 gelten als gleichwertig mit der Abwasseranalyse und Berichterstattung der United States Environmental Protection Agency (USEPA). Die LCK Amver Ammonium-Reagenziensätze gelten nicht als gleichwertig mit der USEPA-Berichterstattung.
Hach hat eine EPA-formatierte Methode mit direkt gegenübergestellten Unterstützungsdaten entwickelt, um die MUR zu befolgen und die Gleichwertigkeit der TNTplus Ammoniak-Salicylat-Reagenzien festzuhalten. Dies wurde bei den älteren TNT Amver Salicylat-Reagenzien nicht durchgeführt. Wenn ein Benutzer die älteren TNT Ammoniak-Tests zur Einhaltung gesetzlicher Vorschriften in Betracht ziehen möchte, kann er dies dennoch mit der zuständigen Behörde besprechen.
Siehe EPA-formatierte Methode „TNTplus Ammonia-Spectrophotometric Measurement of Ammonia Nitrogen and Total Kjeldahl Nitrogen in Water and Wastewater“ für Informationen zur USEPA-Gleichwertigkeit mit 350.1 und 351.1.
Erkennen die Nessler- und die Salicylat-Methode Ammoniak oder Ammonium?
Sowohl die Nessler- als auch die Salicylat-Methode basieren auf einer Reaktion mit molekularem Ammoniak in einer basischen Lösung. Wenn die ursprüngliche Probe Ammonium-Ionen enthält, wandeln die basischen Reagenzien sie in molekulares Ammoniak um, reagieren dann und tragen so zum Endergebnis des Tests bei. Diese einfachen Ammoniumtests umfassen jedoch nicht das Ammonium, das in organisch gebundenen Aminogruppen vorhanden ist. Ein tatsächlicher Test des Gesamt-Ammoniums würde Chloramine enthalten und das Erwärmen der Probe in einer sauren Lösung erfordern, um das organische Ammoniak aufzuschließen.
Since the test result is a sum of both molecular ammonia (NH 3) and ionic ammonium (NH 4 +), the preferred unit for reporting is as nitrogen (NH 3 -N). Most Hach colorimeters and spectrophotometers have the option to convert the test results between nitrogen, ammonia, and ammonium. This does not change the chemistry of the test; it only changes the units. It should be noted that while there is the same amount of nitrogen in ammonia and ammonium, the stoichiometric ratio of N to NH 3 and NH 4 + are not exactly equal due to different number of the hydrogen atoms.
- To convert from mg/L NH 3 -N to mg/L NH 3, multiply by 1.216.
- Calculated from the mass of NH 3 divided by the mass of N (17.034 ÷ 14.01 = 1.216).
- To convert from mg/L NH 3 -N to mg/L NH 4, multiply by 1.288.
- Calculated from the mass of NH 4 + divided by the mass of N (18.042 ÷ 14.01 = 1.288).
Was misst der Amtax sc Analysator tatsächlich?
Wenn die Messung auf dem Amtax sc angezeigt wird, lauten die Einheiten "NH 4 -N" oder "NH 4", was bedeutet, dass die Ergebnisse als Ammonium-Stickstoff oder Ammonium angegeben werden.
Der Amtax sc Analysator fügt Natriumhydroxid (NaOH) hinzu, um den pH-Wert einzustellen und Ammonium-Ionen (NH 4 +) in gasförmiges Ammoniak (NH 3) umzuwandeln, das durch eine für Ammoniakgas selektive Membran strömt und eine pH-Änderung einer Elektrolytlösung verursacht. Diese pH-Änderung im Elektrolyt wird als mV-Signal gemessen, das proportional zur Konzentration von Ammoniak (NH 3) in der Probe ist. .
Welche Ammoniumkonzentration ist für Fische giftig?
Ammonium ist in Wasser entweder als Ammonium-Ionen (NH 4 +) oder als nicht ionisiertes Ammoniak NH 3) vorhanden. Nicht ionisiertes Ammoniak ist für Fische giftig, während das Ammonium-Ion nur bei extrem hohen Konzentrationen giftig ist. Bei dem neutralen pH-Wert 7 und Umgebungstemperatur liegt fast nur Ammonium (NH 4 +) vor. Mit zunehmendem pH-Wert und zunehmender Temperatur steigt der Anteil von NH 3) und der Anteil von NH 4 + sinkt.
Gehen Sie zur Messung der Konzentration von nicht ionisiertem Ammoniak in einer Probe wie folgt vor:
- Messen Sie die Ammoniakkonzentration mithilfe einer beliebigen Ammoniak-Methode außer der Methode für freies Ammoniak.
- Messen Sie den pH-Wert und die Probentemperatur. Siehe Tabelle „Percentage Un-ionized Ammonia in Aqueous Solution by pH Value and Temperature Calculated from data in Emerson, et. al*“ auf Seite 11 im FF2 Freshwater Aquaculture Test Kit Manual.
- Bestimmen Sie den Prozentsatz von NH 3 anhand der Tabelle sowie anhand des pH-Werts und der Temperatur der Probe.
- Multiplizieren Sie die Ammoniakkonzentration mit dem Prozentsatz aus der Tabelle, und teilen Sie den Wert dann durch 100.